TÉCNICAS AVANZADAS EN QUÍMICA
Aplicadas a Nanopartículas
Máster en Química Sostenible
EXTRACCIÓN LÍQUIDO-LÍQUIDO
Método idealmente utilizado para la separación y purificación de nanopartículas miscibles en agua o algún compuesto orgánico. Se suele aprovechar la diferencia de afinidad que tienen, con respecto a las posibles impurezas, para complementar el proceso.
EXTRACCIÓN LÍQUIDO-LÍQUIDO SIMPLE
Este método depende de la diferencia de solubilidad del compuesto a extraer en dos disolventes diferentes. Cuando se agita un compuesto con dos disolventes inmiscibles, el compuesto se distribuye entre los dos disolventes, de acuerdo a su afinidad con ellos.
Es frecuente obtener mezclas en suspensión o disolución acuosa, debido a que muchas de las reacciones se llevan a cabo en medio acuoso, o porque se ha agregado agua sobre la mezcla de reacción inicial. Para este caso, la extracción del producto deseado se consigue añadiendo un disolvente orgánico adecuado, inmiscible con el agua y capaz de solubilizar el compuesto a extraer mejor que el agua, y además, sin extraer las impurezas que lo acompañan en la mezcla de la reacción.
La mezcla de las dos fases es agitada para aumentar la superficie de contacto entre ellas, produciéndose una transferencia del producto deseado desde la fase acuosa hasta la fase orgánica, en una cantidad tanto mayor cuanto mayor sea su coeficiente de reparto entre el disolvente orgánico de extracción elegido y el agua. Posteriormente las dos fases se separan de nuevo por decantación, y el proceso puede repetirse con más disolvente orgánico puro, a fin de extraer la cantidad de producto deseado que pudo quedar en la fase acuosa.
Finalmente se seca la fase orgánica resultante con un agente desecante, se filtra la suspensión resultante y elimina el disolvente orgánico de la disolución seca por destilación o evaporación.
¿ Y LAS NANOPARTÍCULAS ?
- Esta técnica es usada para la separación de algunas nanopartículas cuando se conoce con exactitud la solubilidad de ellas.
- Posterior al proceso de síntesis, para eliminar excesos de compuestos o ligandos, suele realizarse una extracción líquido-liquido. Si tenemos una nanopartícula soluble en medio orgánico y los ligandos y excesos solubles en medio acuoso; esta es la alternativa ideal para separación y purificación.
- En otros casos, como el descrito por Saien y colaboradores, pueden usarse las nanopartículas en sistemas líquido-líquido, para impedir o reducir la transferencia de masa entre una fase y otra.
EXTRACCIÓN LÍQUIDO-LÍQUIDO CONTINUA
Cuando la solubilidad del compuesto a extraer en los disolventes de extracción habituales no es muy elevada, se suele utilizar otro procedimiento que implica una extracción continua de la fase inicial con porciones nuevas del disolvente orgánico de extracción, en un sistema cerrado en el que el disolvente de extracción se calienta y sus vapores se hacen condensar. El disolvente condensado se hace pasar a través de la disolución acuosa, para llegar finalmente con parte del producto extraído al matraz inicial, donde el disolvente orgánico se vuelve a vaporizar, repitiendo un nuevo ciclo de extracción, mientras que el producto extraído, no volátil, se va concentrando en el matraz.
SEPARACIÓN MAGNÉTICA
La separación magnética, es un proceso que sirve para separar dos objetos (en la que uno de los dos debe ser ferroso o tener propiedades magnéticas) a través del uso de separadores como imanes. Es una técnica para separar sustancias que son atraídas por un imán.
El método consiste en acercar un imán a la mezcla a fin de generar un campo magnético, que atraiga al compuesto ferroso dejando solamente al material no ferroso en el contenedor.
En la actualidad se pueden sintetizar diversos tipos de nanopartículas magnéticas. Estas tienen un gran interés en el ámbito biomédico, biosensores, etc. Podemos encontrar nanopartículas de óxido de hierro, de hierro/oro, o de hierro/paladio, entre otros.
Estas NPs pueden tener diferentes aplicaciones:
(i) La separación magnética de células marcadas y otras entidades biológicas.
(ii) Transporte de medicamentos terapéuticos o de radioisótopos.
(iii) Destrucción de tumores a través de hipertermia.
(iv) Agentes de contraste en aplicaciones de resonancia magnética.
Las NPs magnéticas de óxido de hierro y hierro metálico actualmente están atrayendo la atención debido a su enorme utilidad en medicina. Estas NPs pueden utilizarse tanto para aplicaciones in vitro como en aplicaciones in vivo.
http://biblioteca.cio.mx/tesis/15611.pdf
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5618354/pdf/nanomaterials-07-00243.pdf
FILTRACIÓN Y SEPARACIÓN POR MEMBRANA
La técnica de filtración es usada para separar partículas sólidas en un líquido mediante el uso de un material permeable y poroso que actúa como filtro. La técnica de filtración no es usada para separar las mismas nanopartículas pero si es una metodología que puede ser aplicada durante la síntesis de éstas para eliminar impurezas y excesos de reactivos.
La separación por membrana se aplica en el campo de la síntesis de nanopartículas para separar las nanopartículas de la solución donde son sintetizadas. Las membranas encargadas de la separación de las nanopartículas han de tener una alta selectividad basada en el tamaño o la carga.
Una técnica de separación interesante consiste en separar las nanopartículas mediante membranas de silicio nanocristalinas porosas ultrafinas (pnc-Si). Estas membranas, de 15nm de grosor, han demostrado una alta selectividad en cuanto a tamaño para difundir partículas a través de ellas. Estas membranas, además, permiten ser usadas como filtración sin salida para fraccionar nanopartículas de oro con una resolución superior a los 5nm.
Fuente: Gaborski, T. R., Snyder, J. L., Striemer, C. C., Fang, D. Z., Hoffman, M., Fauchet, P. M., & McGrath, J. L. (2010). High-performance separation of nanoparticles with ultrathin porous nanocrystalline silicon membranes. ACS Nano, 4(11), 6973–6981.
Otra membrana de separación interesante es la usada para separar nanopartículas de plata en agua. Esta membrana aprovecha el efecto de la fuerza iónica para retener las AgNPs. La plata total disuelta en el permeado aumenta con la fuerza iónica, debido a que el potencial de carga superficial disminuye, lo que promueve una reducción del espesor de la doble capa, dando como resultado menores rechazos de las AgNPs sobre la membrana.
CRISTALIZACIÓN
Proceso de separación en el que las nanopartículas se separan de la fase líquida por evaporación, por enfriamiento o por adición de una tercera sustancia que provoque el precipitado o disminuya su solubilidad. Una reciente investigación de Pérez-Prieto y colaboradores, utilizó la cristalización para la purificación de nanopartículas de oro rodeadas con MUA, basándose en un simple enfriamiento de la disolución.
Los problemas de la operación son:
-
Rendimiento.
-
Pureza de las nanopartículas.
-
Energía necesaria para enfriamiento o evaporación.
-
Homogeneidad de tamaño.
TIPOS
1. Enfriamiento de una disolución concentrada: Si se prepara una disolución concentrada a altas temperaturas y se enfría, se forma una disolución sobresaturada y el compuesto cristaliza. El enfriamiento suele ser controlado, para así controlar el tamaño de los cristales, ya que si son muy pequeños las impurezas se pueden depositar en la superficie, y si son muy grandes, las impurezas quedan atrapadas dentro de la red cristalina.
2. Evaporación del disolvente: Evaporando el disolvente de una disolución se puede cristalizar sólidos disueltos. Sin embargo, no es un método útil cuando además del sólido de interés contiene impurezas, ya que estas también se quedarán junto al sólido.
3. Sublimación: Algunos compuestos presentan presiones de vapor suficientemente elevadas como para evaporar sin alcanzar su punto de fusión. Los vapores formados se condensan en zonas más frías, pasando habitualmente del estado gaseoso al sólido (sublimación regresiva), separándose de esta manera de las posibles impurezas.
¿ SE PUEDE APLICAR EN NANOPARTÍCULAS ?
- Previa purificación, cuando se tienen nanopartículas (lábiles al calor), con exceso de solvente, puede usarse el proceso de sublimación mediante la técnica de Liofilización. Esta técnica utiliza los fundamentos de sublimación y permite la eliminación de disolventes añadidos, dejando la nanopartícula totalmente seca. Si bien es un proceso de separación de nanopartículas de la fase líquida donde se han sintetizado, debe tenerse en cuenta que no es útil cuando se tiene impurezas en solución.
- N. Enomoto (2017) describe un proceso de cristalización para nanopartículas de hierro, donde se observa claramente que el tiempo, la temperatura y otras variables, pueden influir en el proceso de cristalización, pudiendo obtener desde cristales hasta un material amorfo.
ELECTROFORESIS
1. DESCRIPCIÓN GENERAL DE LA TÉCNICA
La electroforesis es una metodología separativa de uso habitual en el laboratorio. Esta técnica se fundamenta en la separación de moléculas cargadas en un campo eléctrico debido a la movilidad/migración diferencial derivada de la relación carga, forma y masa que posee cada una.
Cabe destacar que el movimiento de las partículas también se encuentra condicionado por la viscosidad del medio, la intensidad del campo eléctrico aplicado, la difusión natural así como también por la temperatura de trabajo. Asimismo, el pH del medio y la fuerza iónica pueden afectar a la velocidad de la partícula modificando su carga neta o produciendo un apantallamiento de su carga, respectivamente.
 |  |
|---|---|
 |  |
-
CARGA:
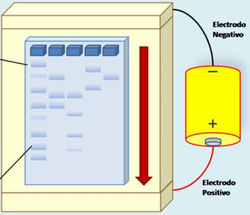
La partícula se desplazará en el medio hacia el polo que posee carga opuesta como consecuencia de la fuerza de atracción eléctrica: las moléculas cargadas positivamente se desplazarán hacia el cátodo (polo negativo) y las cargadas negativamente se desplazarán hacia el ánodo (polo positivo).
-
MASA/TAMAÑO:
Existen diferentes tipos de soportes donde se puede realizar el proceso de electroforesis. Aquellos que son restrictivos (como los de poliacrilamida; PAGE), tienen la ventaja de que variando la concentración de polímero permiten modificar de manera controlada el tamaño del poro. Cuando el tamaño de poro es similar al tamaño de las partículas este puede llegar a oponer resistencia a su movilidad, existiendo un efecto de tamizado molecular donde la separación electroforética depende de la densidad de carga de las moléculas y además de su masa/tamaño.
2. EQUIPAMIENTO:
La fuente de poder se encuentra conectada a la línea de alimentación de corriente, por un lado, y a los electrodos de la cuba, por el otro. Al ser encendida la fuente, se establece una diferencia de potencial entre los compartimentos de la cuba, comenzando la circulación de corriente a través del sistema. En el soporte se siembra la muestra cuyas partículas cargadas se moverán hacia el polo de carga opuesta, de acuerdo a los principios ya explicados.
Existen distintos tipos de soportes como papel, acetato de celulosa, geles (poliacrilamida, agar y agarosas) que se usan en distintas aplicaciones. Aunque lo más utilizados para separación de nanopartículas son los geles de poliacrilamida.
3. ELECTROFORESIS PARA SEPARACIÓN DE NANOPARTÍCULAS (NPs)
La separación electroforética de las NPs se puede llevar a cabo principalmente en función del tamaño, forma y modificaciones químicas de superficie (carga).
-
Separación por tamaño y forma: En aquellas NPs que no presentan modificaciones superficiales y que por tanto no están cargadas, como la migración de las partículas a través del campo eléctrico requiere que presenten carga, se lleva a cabo su adsorción a iones de igual carga permitiendo que la separación se produzca únicamente dependiendo de su tamaño y/o morfología.
-
Separación por carga: En las NPs funcionalizadas que si presentan carga, su separación es dependiente de la cantidad, grupos químicos e ionización de los grupos funcionales anclados a su superficie.
Los tipos de electroforesis más ampliamente estudiados para este fin son electroforesis en gel de poliacrilamida (PAGE) y agarosa, el isoelectroenfoque (IEF) y la electroforesis capilar (CE).
3.1 Electroforesis en gel de poliacrilamida y agarosa:
La electroforesis en gel es una técnica de separación basada en la migración de los analitos limitados en función del tamaño del poro bajo la acción de un campo eléctrico. En los geles de poliacrilamida (PAGE) el tamaño de poro suele ser de unos pocos nm, lo que restringe su aplicación en la separación de NPs con una amplia distribución de tamaños. Por el contrario, el tamaño de poro del gel de agarosa es uniforme y puede ser más grande (de 10 a 100 nm) permitiendo aplicar ampliamente esta técnica en el fraccionamiento de NPs.
3.2 Isoelectroenfoque (IEF):
Técnica que se emplea para separar moléculas cargadas. Esta permite determinar el punto isoeléctrico y separar eficientemente nanoparticulas. Las moléculas cargadas (en nuestro caso NPs) presentan un punto isoeléctrico (pI) que corresponde al valor de pH al cuál la molécula posee carga neta (z) igual a cero (zwitterion), y por lo tanto es inmóvil en un campo eléctrico.
Breve explicación del procedimiento experimental: Se establece un gradiente estable de pH en el gel por adición de anfolitos adecuados (polímeros pequeños con múltiple carga).Se coloca una mezcla de NPs en un pocillo del gel y se aplica un campo eléctrico. Las NPs se distribuyen a lo largo del gel de acuerdo con sus valores de pI.
Al aplicar la diferencia de potencial las partículas que se encuentran en regiones de pH inferior a su punto isoeléctrico estarán cargadas positivamente, y migraran hacia el cátodo; mientras que aquellas que se encuentran en regiones de pH más altos que su punto isoeléctrico tendrán carga negativa y migrarán hacia el ánodo.
3.3 Electroforesis capilar (CE):
La electroforesis capilar (CE) es una técnica de separación basada en un fenómeno por el cual los iones y solutos migran bajo la influencia de un campo eléctrico y son separados por las diferencias entre las movilidades electroforéticas como consecuencia de la diferente relación carga/tamaño dentro de un tubo capilar lleno de disolución tampón. Algunas generalidades sobre esta técnica son comentadas a continuación (Cruces-Blanco, 1998). Además, las técnicas de electromigración capilar se han aplicado recientemente en la separación selectiva de NPs por tamaño y densidad de carga superficial.
Los elementos necesarios para llevar a cabo una electroforesis son los siguientes:
-
Fuente de alto voltaje: hasta 30 kV.
-
Capilar: generalmente son de sílice fundida. Su diámetro oscila entre 25 y 100 µm y el externo es de 375 µm.
-
Detector: el más utilizado es el de UV/Vis, aunque también se pueden utilizar detectores de fluorescencia, espectrometría de masas y menos frecuentemente, detectores de quimioluminiscencia, fosforescentes y espectrometría Raman.
-
Viales: además del vial de muestra son necesarios un vial con agua, otro con hidróxido sódico y otro con una disolución tampón para acondicionar el capilar, un vial vacío como desecho y dos más con el tampón electroforético.
-
Sistema de introducción de la muestra: Se puede aplicar un potencial sobre el vial de muestra (inyección hidrodinámica) aunque también se puede hacer mediante la aplicación de voltaje (inyección electrocinética). Otra posibilidad es elevar el vial de entrada para que la muestra entre por gravedad (inyección por efecto sifón).
-
Sistema de termostatización del capilar: con este sistema se consigue evitar el aumento de la temperatura por efecto Joule, manteniéndola constante durante todo el análisis.
En las separaciones electroforéticas existen dos fenómenos simultáneamente: la electroósmosis y la electromigración, que dan lugar a dos flujos: el llamado flujo electroforético y el flujo electroosmótico.
El flujo electroosmótico (EOF) se debe al movimiento de la disolución tampón por el capilar cuando se aplica un campo eléctrico. Éste se produce del polo positivo al negativo, es decir, el tampón se mueve del vial de entrada a través del capilar hacia el detector y el vial de salida. Como la pared del capilar está compuesta por grupos silanol (Si-OH), al utilizar soluciones tampón básicas, esta superficie se carga negativamente con grupos silanoato (Si-O-). Esto hace que los H+ u otras cargas positivas libres se sitúen cerca de estas cargas negativas formando una doble capa. Al aplicar una diferencia de potencial, esas cargas libres (positivas y negativas) se moverán hacia los polos contrarios. Como las cargas negativas situadas en la pared no pueden moverse, existe un flujo de cargas positivas hacia el polo negativo. Con su desplazamiento se provoca el movimiento de todo el seno de la disolución tampón, desplazando en el mismo sentido a todas las especies independientemente de su carga (EOF).
El flujo electroforético se produce, cuando bajo la acción de un campo eléctrico, los solutos iónicos (especies cargadas) se desplazan a través del capilar. Esto se produce por dos razones: por un lado, por el efecto del EOF que arrastra todo el seno de la disolución y, por tanto, también los solutos iónicos. Por otro lado, la propia carga del soluto hace que éste muestre una movilidad por sí mismo, la cual va en función de su carga (q), la del radio de la molécula (r) y la de la viscosidad del medio (η), según la ecuación (Ruiz-Marrondo, 2001).
𝜇= q/6rπη
A continuación, se puede observar gráficamente como se produce la separación en el interior del capilar en el sistema electroforético:
En general, existen diferentes modalidades de CE, las cuales tienen solo en común que se llevan a cabo en un capilar estrecho con una fuente de alta tensión que proporciona el voltaje requerido en la separación. Los diferentes métodos de electroforesis, según las definiciones propuestas por la Farmacopea Europea y la Unión Internacional de Química Pura y Aplicada (IUPAC) (Riekkola et al., 2004) son:
-
Electroforesis capilar zonal (CZE, por sus siglas en inglés): Se trata de la modalidad más empleada por ser la más sencilla y consiste en rellenar todo el capilar con un electrolito de fondo que en la mayoría de los casos es un tampón. La separación se consigue porque los diferentes componentes de la muestra migran en banda discretas con diferentes velocidades, es decir, presentan una movilidad libre en disolución. Solo es posible separar los analitos que presentan cargas mientras que los neutros quedan agrupados en una banda, no siendo posible su resolución.
-
Cromatografía capilar electrocinética micelar (MEKC, por sus siglas en inglés): La separación se lleva a cabo utilizando disoluciones micelares de surfactantes iónicos a concentraciones superiores a la concentración micelar crítica (CMC), permitiendo la separación de moléculas tanto cargadas como neutras.
-
Electrocromatografía capilar (CEC, por sus siglas en inglés): la fase móvil se mueve a través del capilar, empaquetado o cubierto con fase estacionaria. La retención es debida a la combinación entre la migración electroforética y la retención cromatografía. La ventaja de CEC sobre la cromatografía dirigida con presión es que no hay una presión límite sobre el tamaño de las partículas que se pueden utilizar.
-
Electroforesis capilar en gel (CGE, por sus siglas en inglés): la separación tiene lugar dentro del capilar el cual esta relleno de un gel que actúa como un tamiz molecular. Las moléculas con similar relación carga/masa se separan dependiendo del tamaño molecular, ya que las moléculas más pequeñas se moverán con mayor libertad a través de la red de gel y migrarán más rápidamente que las moléculas más grandes.
-
Enfoque Isoeléctrico Capilar o Isoelectroenfoque (CIEF, por sus siglas en inglés): La separación tiene lugar gracias a la aplicación de un campo eléctrico a lo largo de un gradiente pH formado en el capilar. Se usa para separar analitos anfotéricos como proteínas y péptidos basándose en sus diferentes puntos isoeléctricos.
-
Isotacoforesis (CITP, por sus siglas en inglés): Separación electroforética similar a CZE pero que lugar en un tampón discontinuo en el cual los analitos migran de acuerdo a sus movilidades electroforéticas formando una cadena de zonas con igual velocidad entre dos disoluciones, el tampón de entrada y el de salida son diferentes.
CROMATOGRAFÍA
La cromatografía es una técnica que permite separar los componentes de una mezcla debido a su diferente afinidad (velocidad) entre dos fases inmiscibles entre sí, una estacionaria (líquida o sólida) y otra móvil (gas o líquida).
La velocidad a la que cada uno de los compuestos es arrastrado dependerá tanto de su solubilidad en la fase móvil, como de la intensidad de la interacción de dicho compuesto con la fase estacionaria.
Las interacciones que existen entre las moléculas de los analitos, las de la fase estacionaria y las de la fase móvil dependen de la naturaleza de las fases y dan lugar a los distintos tipos de cromatografía.

Cromatografía en fase reversa: la fase móvil es un líquido polar. La retención tiene lugar como consecuencia de la partición y adsorción de los analitos en la fase estacionaria. Las moléculas son más retenidas cuanto más grandes y apolares son, y son más rápidamente eluidas cuando más solubles en agua son.
Cromatografía en fase normal: la fase estacionaria es un sólido polar de alta superficie específica. La retención tiene lugar fundamentalmente por adsorción. Los compuestos más polares son los más retenidos.
Cromatografía de afinidad: se basa en la unión reversible entre el analito y un ligando específico, inmovilizado en un soporte sólido inerte. Cuando la fase móvil pasa por la columna, sólo son retenidas las moléculas que se unen de manera selectiva al ligando por afinidad. Se ha utilizado para la purificación de nanopartículas MIP (Moleculary Imprinted Polymers).
Cromatografía de exclusión: la fase estacionaria es un sólido extremadamente poroso en el que los poros tienen tamaños definidos. Las moléculas pequeñas pueden penetrar en los poros y viajan lentamente, las moleculas más grandes no pueden entrar en los poros y cruzan la columna a gran velocidad circulando sólo por lo canales más grandes y cortos.
Esta técnica es la más utilizada para la separación y purificación de nanopartículas.
Se han comparado diferentes técnicas de las anteriormente nombradas para la separación de NPs por tamaño y forma.
se ha utilizado para separar Au NPs de diferentes tamaños en fase acuosa y orgánica.
CENTRIFUGACIÓN
Técnica de separación utilizada para aislar o concentrar partículas que se encuentras suspendidas en un líquido.
Se denomina fuerza centrífuga a aquella que se ejerce sobre un cuerpo cuando gira alrededor de un eje. La fuerza es directamente proporcional a la masa del cuerpo. Dependiendo de la fuerza centrífuga se puede variar el proceso de sedimentación tanto de partículas que tienen tendencia a hacerlo espontáneamente (densidad superior a la del líquido) como en aquellas que tienden a flotar (densidad inferior a la del líquido).
Se pueden clasificar las centrifugas dependiendo de su velocidad o según el medio en el que se centrifuga y la forma de cómo se aplique la muestra:
1.- Según su velocidad.
2.- Según el medio en el que se centrifuga y cómo se aplica la muestra.
Algunos métodos de separación por centrifugación más actuales son las siguientes:
1- Separación por centrifugación de nanopartículas mediante cambios de densidad (DCC).
2- Centrifugación en gradiente.
- Polimerización directa de monómeros en una centrífuga.
- Fabricación de cristales fotónicos macroscópicos independientes mediante centrifugación.
- Sedimentación de partículas en gradiente de pH.
1- Separación por centrifugación de nanopartículas mediante cambios de densidad (DCC) (Han, Zhan, Sun, Zhang, & Deng, 2019)
Los sistemas de administración de fármacos en partículas, que incluyen nanopartículas y lípidos son de interés por científicos farmacéuticos y los médicos. Estos sistemas, pueden utilizarse en múltiples campos, como la terapia de tumores, imágen y diagnóstico, inmunorregulación y suplemento nutricional. Generalmente, los medicamentos bioactivos o los materiales funcionales están encapsulados y, para medir esta eficiencia de encapsulamiento, va a depender de la separación completa del medicamento atrapado en la nanoparticula del medicamento libre. Para ello, se introduce un nuevo método de separación denominado centrifugación con cambio de densidad (DCC), que se basa en citrato trisódico (TC) y ultracentrifugación. Para medir la viabilidad de la DCC, se tomaron como modelo de partículas de administración las nanopartículas lipídicas sólidas (SLN) y los liposomas. Las SLN se cargaron con un fármaco hidrófobo (paclitaxel, PTX), mientras que los liposomas se cargaron con un fármaco hidrófilo (clorhidrato de doxirrubicina, Dox). Una vez realizada la separación por este método, se evaluó mediante la eficiencia de encapsulación y el efecto Tyndall. Esta técnica es ventajosa respecto a de las que han estado utilizando los últimos años ya que por ejemplo la ultracentrifugación a parte de necesitar un equipo de un alto coste, necesita tiempos de centrifugación bastante elevados llegando a producir una fuga del fármaco. Además, la ultracentrifugación al separar los medicamentos libres de las partículas por diferencia de peso, densidad o viscosidad, la densidad tanto de las partículas como de los liposomas y las nanopartículas están muy cercanas a la densidad del medio líquido dificultando una separación adecuada. Por ello, la DCC utiliza TC para que las partículas se vuelvan mucho más ligeras que el líquido y, a la hora de realizar la ultracentrifugación, se pueda realizar sin problema. Por otro lado, la cromatografía de exclusión por tamaño (SEC), aun siendo uno de los métodos más utilizados para cromatografía, necesita de un tiempo largo de elución y un gran volumen de elución que puede dar como resultado la dilución de la muestra, además de una mala recuperación de los fármacos modelo. Se ha llegado a desarrollar un método de separación simple y eficiente basado en TC y ultracentrifugación para la separación rápida de fármacos libres de los SLN cargados con PTX y los liposomas cargados con Dox.
2- Centrifugación en gradiente para aplicaciones analíticas y preparativas (Spinnrock & Cölfen, 2019)
La centrifugación en gradiente tiene especial importancia en química, biología, ciencia de los materiales e ingeniería. Tiene un gran potencial más allá de la conocida centrifugación para la separación de moléculas y partículas. Un ejemplo es la polimerización directa de monómeros en una centrifuga, que se puede utilizar para producir materiales poliméricos con gradientes inherentes3 (van Duijnhoven & Bastiaansen, 2008). Se genera un gradiente de composición por sedimentación de un polímero (por ejemplo, metacrilato de propilo) en solución de monómero (por ejemplo, metacrilato de metilo (MMA)). El monómero se polimeriza por polimerización térmica mientras la centrifugadora está girando. De esa manera, el gradiente de la composición se fija y se obtiene un gradiente de índice de refracción cuando los dos polímeros tienen diferentes índices de refracción. Se pueden producir vidrios poliméricos altamente transparentes que son prometedores para óptica. Otro método novedoso es la fabricación de cristales fotónicos macroscópicos independientes mediante centrifugación4 (Xu, Franke, Schilling, Sommerdijk, & Cölfen, 2019). Con la capacidad de medir, analizar y simular el comportamiento de la concentración, se puede comprender la formación de fase y se pueden producir cristales coloidales. Por lo tanto, para comprender la formación de diferentes fases cristalinas y amorfas en los campos centrífugos, es necesaria la medición en tiempo real de la concentración de partículas coloidales. Por último, otro método novedoso para determinar las distribuciones de carga de partículas es la sedimentación de partículas en gradientes de pH5 (Part, 2006). En primer lugar, se acumuló un gradiente de pH mediante un ciclo de sedimentación en equilibrio de poli (sulfonato de 4-estireno sódico). Luego, las partículas de oro coloidal con carga catiónica-aniónica se centrifugaron. La velocidad de sedimentación estuvo influenciada por el efecto de carga primaria, la agregación y la exclusión de volumen a diferentes valores de pH. Esta técnica puede usarse potencialmente para investigar interacciones macromoleculares y transformaciones dependientes del pH de microgeles y macromoléculas.